一、怎么解化学溶解度曲线图的题
溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度的变化情况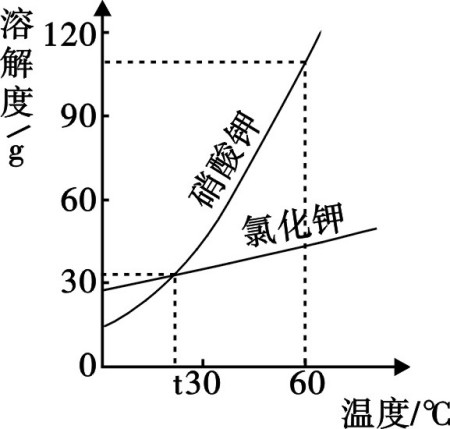 曲线的坡度越大,说明溶解度受温度影响越大;反之,说明受温度影响较小。溶解度曲线也有三个方面的应用:
曲线的坡度越大,说明溶解度受温度影响越大;反之,说明受温度影响较小。溶解度曲线也有三个方面的应用:
(1)根据溶解度曲线,可以看出物质的溶解度随着温度的变化而变化的情况。
(2)根据溶解度曲线,比较在一定温度范围内的物质的溶解度大小。
(3)根据溶解度曲线,选择分离某些可溶性混合物的方法。
溶解度曲线特征
(1)大部分固体物质的溶解度曲线左低右高,溶解度随温度的升高而增加;
溶解曲线
(2)少数固体物质的溶解度曲线较平缓,溶解度受温度的影响小,如食盐;
(3)极少数固体物质的溶解度曲线是左高右低,溶解度随温度的升高而降低,如熟石灰;用溶解性表示物质的溶解能力是定性的,粗略的。
溶解度曲线的应用
(l)由已知温度查某物质对应的溶解度;
溶解曲线
(2)由物质的溶解度查该物质所处的温度;
(3)比较同一温度下不同物质的溶解度;
(4)设计混合物分离或提纯的方法,例如提纯NaCl可用蒸发溶剂法,分离NaCl和NaNO3可用降温结晶法。
关于溶质的质量分数的计算
大致包括以下四种类型:
(1)已知溶质和溶剂的量,求溶质的质量分数;
(2)要配制一定量的溶质的质量分数一定的溶液,计算所需溶质和溶剂的量;
(3)溶液稀释和配制问题的计算;
(4)把溶质的质量分数运用于化学方程式的计算。
二、初中化学的溶解度曲线如何理解,重点是什么!
近年来,以溶解度曲线为切入点的试题已成为学业评价考试命题的热点之一。此类题往往需要学生在全面了解溶解度曲线意义的基础上,运用数学知识比较一些物质在同一温度或不同温度溶解度的大小,进行物质结晶或溶解的相关计算等。下面,从三个方面对溶解度曲线的理解及其应用进行探析。
一、溶解度曲线的特点
1. 大多数固体物质的溶解度曲线左低右高,呈“陡升型”,溶解度随温度升高而增大。如硝酸钾等。
2. 少数固体物质的溶解度曲线较平缓,呈“缓升型”,溶解度受温度的影响很小。如氯化钠等。
3. 极少数固体物质的溶解度曲线是左高右低,呈“下降型”,溶解度随温度的升高反而降低。如氢氧化钙等。
4. 气体物质的溶解度均随温度的升高而减小,曲线也呈“下降型”。
二、溶解度曲线的含义
固体物质的溶解度曲线,是在以温度为横坐标,溶解度为纵坐标的平面直角坐标系内所给出的固体物质溶解度随温度变化的曲线。因此,同学们应从点、线、面三个方面去理解固体物质溶解度曲线的含义。
1. 点。(1)每条曲线上的点,表示该点所示的温度下该物质的溶解度。如点a表示A物质在ta℃时的溶解度是mag
(2)两条曲线的交点表示在该点所示的温度下,两种物质的溶解度相同。如上图中b点表示tb℃时,A、B两物质的溶解度都为mbg。
2. 线:不同的溶解度曲线表示不同物质在不同温度下的溶解度或溶解度随温度变化的趋势。如上图中,A物质的溶解度受温度变化的影响最大,而C物质的溶解度受温度变化的影响最小。
3. 面。(1)曲线上面的各点,表示在对应温度下的溶液是饱和溶液,且溶液中有未溶解的晶体。如,上图中的c点表示在tc℃时A的饱和溶液,且有(mc-m)g未溶解的固体析出。
(2)曲线下面的各点,表示该物质在该温度下的不饱和溶液。如,在上图中d点就表示在tc℃时A物质的不饱和溶液,还需再加(m—md)gA物质,溶液才能达到饱和。
三、溶解度曲线的应用
1. 查找指定温度下某物质的溶解度,并根据其溶解度判断溶解性。
2. 比较同一温度下(或一定温度范围内)不同物质溶解度的大小;位于上方的曲线所代表的物质的溶解度大于位于下方的曲线所代表的物质的溶解度。若两种物质的溶解度曲线相交,则在交点所对应的温度下两种物质的溶解度相等。
3. 比较和确定物质的溶解度受温度影响的程度,并据此确定物质从饱和溶液中析出晶体或混合物分离提纯的方法。
4. 确定溶液的状态(饱和溶液与不饱和溶液)。
三、溶解度曲线怎么做呀
首先,要弄清楚溶解度及溶解度曲线的概念。某固体物质在100克溶剂里(通常为水)达到饱和状态时所能溶解的质量(在一定温度下,100克溶剂里溶解某物质的最大量)即为该物质的溶解度,溶解度单位:克。一般情况下,不同温度时,物质的溶解度不同,根据不同温度下物质的溶解度可以画出溶解度曲线。
针对本题,从图中可以看出,甲的溶解度受温度影响大,而乙的溶解度受温度影响小。
选项A 正确 甲、乙的溶解度曲线在t1温度时相交,所以溶解度相同,为50g。
选项B 错误 虽然t2温度时甲的溶解度大于乙的溶解度,但是饱和溶液时,当溶剂质量相同时溶解的甲才多,需要限定溶剂的量。
选项C正确 进行一下溶质的质量分数计算就可以了, t2温度时甲的溶解度大,溶质的质量分数大
选项D正确 甲的溶解度受温度影响大,冷却热的饱和溶液时,会析出大量的甲,通过过滤提取出甲而进行提纯
请采纳答案,支持我一下。
四、怎么看溶解度曲线图
结合横坐-标温度,纵坐标-溶解度,当温度10℃,KNO3的溶解度20,既10℃时100克水最大溶解20克KNO3,同时NaCl的溶解度为35,在20℃时,两种物质的溶解度相同,都是37克,,另外KNO3的溶解度随温度升高,溶解度迅速增大,而NaCl溶解度增大不多。
五、溶解度曲线图 理解
溶解度曲线的意义及其应用
溶解度曲线的意义与应用可从点、线、面和交点四方面来分析。
1.点 溶解度曲线上的每个点表示的是某温度下某种物质的溶解度。溶解度曲线上的点有三个方面的作用: (1)根据已知温度查出有关物质的溶解度; (2)根据物质的溶解度查出对应的温度; (3)比较相同温度下不同物质溶解度的大小或者饱和溶液中溶质的质量分数的大小。
2.线 溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度的变化情况。曲线的坡度越大,说明溶解度受温度影响越大;反之,说明受温度影响较小。溶解度曲线也有三个方面的应用: (1)根据溶解度曲线,可以看出物质的溶解度随着温度的变化而变化的情况。 (2)根据溶解度曲线,比较在一定温度范围内的物质的溶解度大小。 (3)根据溶解度曲线,选择分离某些可溶性混合物的方法。
3.面 对于曲线下部面积上的任何点,依其数据配制的溶液为对应温度时的不饱和溶液;曲线上部面积上的点,依其数据配制的溶液为对应温度时的饱和溶液,且溶质有剩余。如果要使不饱和溶液(曲线下部的一点)变成对应温度下的饱和溶液,方法有两种:第一种方法是向该溶液中添加溶质使之到达曲线上;第二种方法是蒸发一定量的溶剂。
4.交点 两条溶解度曲线的交点表示该点所示的温度下两物质的溶解度相同,此时两种物质饱和溶液的溶质质量分数也相同。
例题(98年广西区)X、Y、Z三种固体物质的溶解度曲线见右图。
下列说法中,不正确的是( )。
(A)分别将X、Y、Z的饱和溶液的温度从t2 ℃降低到t1 ℃,只有Z无晶体析出
(B) t1 ℃时,用l00克水配制相同质量、相同溶质质量分数的X、Y、Z的溶液,所需溶质质量最多不超过Sy
(C)当X中含有少量Y时,可用结晶法提纯X
(D) t2 ℃时,三种物质的饱和溶液中溶质的质量分数X>Y>Z
解析 这是一道难度较大的综合选择题,它综合了饱和溶液、不饱和溶液、蒸发结晶、物质的提纯及质量分数与溶解度的换算等知识。解题的关键是看懂溶解度曲线图并明确溶解度曲线的意义。
(A)从曲线图可知,只有Z物质的溶解度随温度的升高而减少,故降低温度时,X、Y的饱和溶液均有晶体析出,而Z没有。
(B)在t1 ℃时,X、Y、Z的溶解度分别为Sx、Sy、Sz,如需配制相同质量、相同质量分数的溶液,其溶质质量最多不超过Sx,不是Sy。
(C)当X中混有少量Y时,由于X的溶解度随温度的变化有显著的改变,而Y的溶解度随温度变化基本上不变,故可用结晶法提纯X。













